2025 诺奖新视角:Treg 细胞、肠道菌群与人体免疫稳态有什么关联?
你有没有过这样的疑问:为什么有的人吃海鲜、碰花粉就红疹发痒,有的人却能自在接触各类物质?为什么免疫系统有时会 “敌我不分”,对着自身器官发起攻击,有时又对异常细胞 “视而不见”?2025 年诺贝尔生理学或医学奖,终于为这些疑问揭开了关键谜底 ——外周免疫耐受机制,尤其是调节性 T 细胞(Treg 细胞)的功能发现。这一研究成果为肠道菌群免疫调节研究提供了新视角,与肠道菌群的免疫调节路径存在关联,也为日常健康管理带来了新的思考方向。

一、Treg细胞:肠道里的“免疫平衡指挥官”
在人体复杂的免疫体系中,Treg 细胞并非直接参与对抗病原体的 “冲锋部队”,而是扮演着 “精准执法的指挥官” 角色 —— 它们不主动攻击外敌,却能通过调控其他免疫细胞的活性,防止免疫系统 “误伤友军”。简单来说,当免疫系统遇到细菌、病毒等外来入侵者时,Treg 细胞会 “放行” 攻击信号;可当免疫细胞误将自身细胞、无害物质(如牛奶蛋白、尘螨)当作 “敌人” 时,Treg 细胞就会及时 “踩刹车”,避免过度免疫反应引发过敏、湿疹甚至自身免疫病。

研究证实,当 Treg 细胞数量不足或功能减弱时,免疫系统会陷入 “混乱”:要么对无害物质过度敏感,诱发反复过敏;要么持续攻击自身组织,导致类风湿关节炎、慢性肠炎等问题 [1]。
而肠道作为人体最大的免疫器官,正是 Treg 细胞发育成熟、发挥功能的核心场所 —— 这里不仅为 Treg 细胞提供 “生长土壤”,更通过肠道菌群的代谢活动,为其注入 “工作能量”。
二、肠道菌群:Treg细胞的“能量补给与环境搭建者”
Treg 细胞的功能发挥,离不开肠道菌群的 “鼎力支持”。肠道菌群就像一个 “微型工厂”,通过发酵膳食纤维等底物,持续产生短链脂肪酸(如丁酸、乙酸)—— 这类物质是 Treg 细胞维持活性与增殖的 “核心能量源”。国际顶尖研究数据显示,肠道菌群代谢产生的短链脂肪酸,可使肠道内 Treg 细胞数量提升 30%-50%,同时显著增强其抑制过度免疫反应的能力 [2-6]。
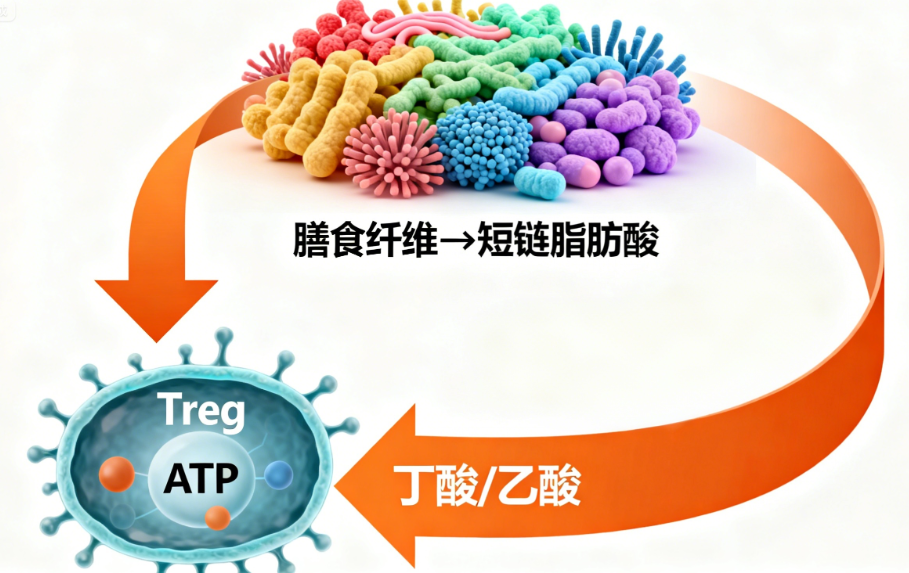
不仅如此,肠道菌群还能为 Treg 细胞 “稳定工作环境”:健康的菌群结构可抑制梭状芽孢杆菌、致病性大肠杆菌等有害菌生长,减少其释放的内毒素、促炎物质对免疫系统的刺激 —— 若有害菌过度增殖,会导致 Treg 细胞 “疲于应对” 外源干扰,无法专注于免疫平衡调控。可以说,肠道菌群的平衡状态,直接决定了 Treg 细胞能否 “正常履职”;而脆弱拟杆菌 BF839,正是优化肠道菌群、赋能 Treg 细胞的关键力量。
三、脆弱拟杆菌:让免疫平衡从“隐形”走向“可干预”
如果把 Treg 细胞比作 “免疫刹车”,肠道菌群是 “刹车系统的支撑架构”,那么脆弱拟杆菌 就是连接二者的 “智能转换器”—— 它不仅能优化肠道微生态,更能通过三大核心机制,让 Treg 细胞的调节功能精准落地,将抽象的 “免疫平衡” 转化为可感知、可干预的健康方案。
01分泌活性物质,为 Treg 细胞 “精准赋能”
脆弱拟杆菌能产生两种对 Treg 细胞至关重要的 “能量与信号物质”:
荚膜多糖 A:这是 BF菌 特有的功能性成分,可直接作用于肠道黏膜中的免疫前体细胞,激活 “Treg 细胞分化信号通路”,推动更多未成熟免疫细胞转化为具备调节功能的成熟 Treg 细胞 ;
短链脂肪酸:通过发酵肠道内的膳食纤维,BF菌可持续生成丁酸等短链脂肪酸,为 Treg 细胞提供 “续航能量”,确保其抑制过度免疫的能力始终在线。
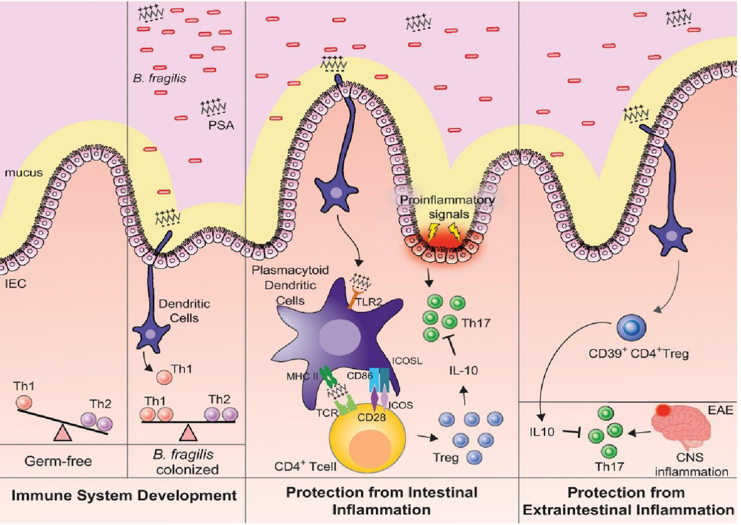
BF菌是典型的共生分子,对哺乳动物免疫系统的发育以及对产生IL-10的CD4 + Treg细胞的激活具有关键影响[7];因此,在自身免疫,炎症和传染病方面赋予宿主好处。被称为“免疫菌”和“抗癌菌”。
02修复肠道屏障,为 Treg 细胞 “稳固战场”
肠道屏障是 Treg 细胞发挥功能的 “重要依托”:若肠道上皮细胞连接松散(如紧密连接蛋白减少),病原体、毒素会 “突破防线” 进入血液循环,导致 Treg 细胞被迫 “分心应对外源入侵”,无法专注于免疫平衡调控。
脆弱拟杆菌可通过双重路径加固肠道屏障:一方面,促进肠道上皮细胞表达 occludin、ZO-1 等紧密连接蛋白,增强物理屏障的 “密封性”[8];另一方面,其代谢产物抑制巨噬细胞产生TNF-α、IL-1β等促炎因子,减少炎症因子对肠道屏障的破坏[9] 。当肠道屏障稳定时,Treg 细胞才能 “专心工作”,精准调控免疫反应的强度与范围。
03平衡菌群稳态,减少 Treg 细胞 “干扰负担”
面对肠道内有害菌的 “竞争”,脆弱拟杆菌通过 “竞争抑制” 与 “主动抗菌” 双管齐下:它能优先占据肠道黏膜表面的附着位点,“挤压” 有害菌的生存空间;同时分泌细菌素类似物,直接抑制梭状芽孢杆菌等有害菌的生长及毒素释放 。当肠道菌群恢复平衡,有害菌产生的促炎物质大幅减少,Treg 细胞的 “调节负担” 显著减轻,免疫平衡自然更易维持。
四、从诺奖理论到日常健康:免疫管理的新路径
2025 年诺贝尔生理学或医学奖揭示的核心要义表明:人体健康的关键不在于追求免疫功能的极致强大,而在于维持精妙的免疫平衡状态。—— 既要守住对抗病原体的防线,又要避免对自身组织造成伤害。而脆弱拟杆菌 BF839 的价值,就在于将这一 “实验室理论” 转化为普通人可触及的健康方案:
针对炎症易感人群:若经常出现反复炎症、慢性腹泻,补充 BF839 可通过赋能 Treg 细胞、修复肠道屏障,减轻免疫过度反应,缓解炎症状态 ;
针对过敏高风险人群:对于易过敏体质或儿童,BF839 可增强 Treg 细胞对 “无害物质” 的识别能力,降低湿疹、食物过敏的发生率;
针对菌群失衡人群:婴幼儿补充 BF839 可促进肠道菌群向 “成熟态” 发展,为 Treg 细胞提供优质 “生长土壤”;老年人补充则能改善菌群多样性下降问题,延缓 Treg 细胞功能衰退 。
五、图腾生命:让微生态健康方案落地生根
图腾生命深耕微生态健康领域,始终聚焦脆弱拟杆菌 BF839 的研究与应用。依托独家生物技术,公司建立了从菌株分离驯化、高密度培养到制剂研发的全链条体系,已成功开发多款以脆弱拟杆菌 BF839 为核心成分的益生菌产品。
通过严谨的临床研究与实践验证,这些产品在癫痫、银屑病、自闭症、帕金森、肿瘤等方面展现出显著成效。图腾生命致力于为免疫事业而奋斗!为更多人守护肠道健康、筑牢免疫防线,推动微生态健康产业迈向高质量发展新阶段。
参考文献:
[1] Neuwirth, T., Malzl, D., Knapp, K., Tsokkou, P., Kleissl, L., Gabriel, A., Reininger, B., Freystätter, C., Marella, N., Kutschat, A. P., Ponweiser, E., Haschemi, A., Seruggia, D., Menche, J., Wagner, E. F., & Stary, G. (2025). The polyamine-regulating enzyme SSAT1 impairs tissue regulatory T cell function in chronic cutaneous inflammation. Immunity, 58(3), 632–647.e12.
[2] Träger, C., Kaiser, M., Freudenstein, D., Heckscher, S., Dettmer, K., Oefner, P. J., Liebisch, G., Hiergeist, A., Gessner, A., Lee, D. H., Angstwurm, K., Linker, R. A., & Haase, S. (2025). A probiotic approach identifies a Treg-centred immunoregulation via modulation of gut microbiota metabolites in people with multiple sclerosis and healthy individuals. EBioMedicine, 116, 105743.
[3] Arpaia, N., Campbell, C., Fan, X., Dikiy, S., van der Veeken, J., deRoos, P., Liu, H., Cross, J. R., Pfeffer, K., Coffer, P. J., & Rudensky, A. Y. (2013). Metabolites produced by commensal bacteria promote peripheral regulatory T-cell generation. Nature, 504(7480), 451–455.
[4] Furusawa, Y., Obata, Y., Fukuda, S., Endo, T. A., Nakato, G., Takahashi, D., Nakanishi, Y., Uetake, C., Kato, K., Kato, T., Takahashi, M., Fukuda, N. N., Murakami, S., Miyauchi, E., Hino, S., Atarashi, K., Onawa, S., Fujimura, Y., Lockett, T., Clarke, J. M., Topping, D. L., Tomita, M., Hori, S., Ohara, O., Morita, T., Koseki, H., Kikuchi, J., Honda, K., Hase, K., & Ohno, H. (2013). Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells. Nature, 504(7480), 446–450.
[5] Smith, P. M., Howitt, M. R., Panikov, N., Michaud, M., Gallini, C. A., Bohlooly-Y, M., Glickman, J. N., & Garrett, W. S. (2013). The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science, 341(6145), 569–573.
[6] Resta-Lenert, S., & Barrett, K. E. (2003). Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC). Gut, 52(7), 988–997.
[7]Erturk-Hasdemir D, Kasper DL. Finding a needle in a haystack: Bacteroides fragilis polysaccharide A as the archetypical symbiosis factor. Ann N Y Acad Sci. 2018;1417(1):116-129. doi:10.1111/nyas.13660
[8]LEI Qi-yi, XU Yang, LI Peng-fei. Influence and Mechanism ofBacteroides fragilisType VI Secretory System on the Intestinal Barrier[J]. Biotechnology Bulletin, 2024, 40(3): 286-295.
[9]吴松婷, 鲁晓岚. 肠道菌群破坏肠道黏膜屏障调控代谢相关脂肪性肝病炎症、免疫与代谢紊乱的研究进展. 世界华人消化杂志 2025; 33(5): 337-343