银屑病褪去,她的笑容回来了——营养肠道微生态治疗案例
作者:林楚慧
银屑病
银屑病的患病率为 0.47%,是一种遗传与环境共同作用诱发、免疫介导的慢性、复发性、炎症性、系统性疾病,与典型临床表现为鳞屑性红斑或斑块,局限或广泛分布,治疗困难,常罹患终身。
案例展示
初识陈阿姨,
瘦弱且单薄,
她的表情像是一本书,
仿佛记载了很多个难熬的日日夜夜。
一年前,她被诊断患上了银屑病,这一年来,皮肤问题像是无休止的噩梦,让她备受煎熬。她的皮肤上,两只手关节处的皮疹最为严重,鲜明的皮肤分界线、厚重的白黄色皮屑让她的双手变得陌生而疼痛。
除了双手关节,她的膝盖、小腿以及屁股两侧,都遭受着同样的痛楚。尽管整体皮疹面积不算大,但严重程度令人担忧。陈阿姨这一年来深受瘙痒疼痛之苦,整日坐卧不安。为了缓解痛苦,陈阿姨有时会涂抹一些药膏,但效果不佳。除了皮肤问题外,陈阿姨还出现经常腹泻、大便稀烂。
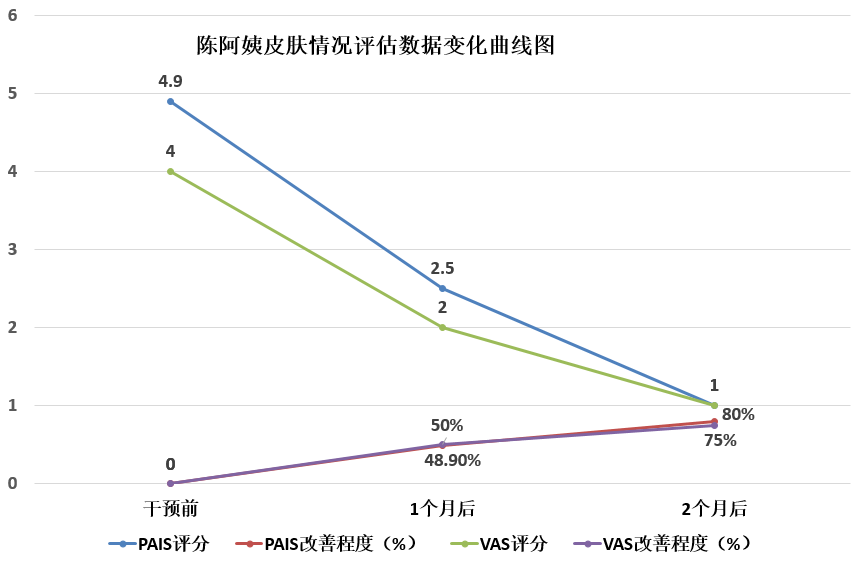
听着陈阿姨的诉说,言语中尽是苦楚和想要得到有效治疗的急迫。我安抚了她的情绪,先给她做了皮损评估,她的PAIS评分达到4.9分,瘙痒VAS评分为4分。根据陈阿姨主诉和皮肤评估检查情况,我给她制定了肠道微生态治疗方案,以及规律饮食建议。
一个月后,回来复诊的陈阿姨眼神中透露出一些失望。我理解她内心的焦虑,因为长时间的煎熬,许多患者希望短时间内就能痊愈,然而疾病的治疗往往需要耐心和时间。事实上,她的皮肤状况肉眼可见已有所改善,皮屑逐渐消失,颜色变淡,瘙痒也减轻了。我对陈阿姨进行了第二次测评,PAIS评分下降至2.5分,改善了48.9%,瘙痒VAS评分下降至2分,改善了50%。皮肤情况和评估数据的改善告诉我们,治疗在起作用,只是需要更多时间。皮肤问题的缓解是一个逐步过程,需要持续的努力和配合。经过我的分析和解释,陈阿姨恢复了一些信心,愿意继续坚持肠道微生态+饮食调整的治疗方案。
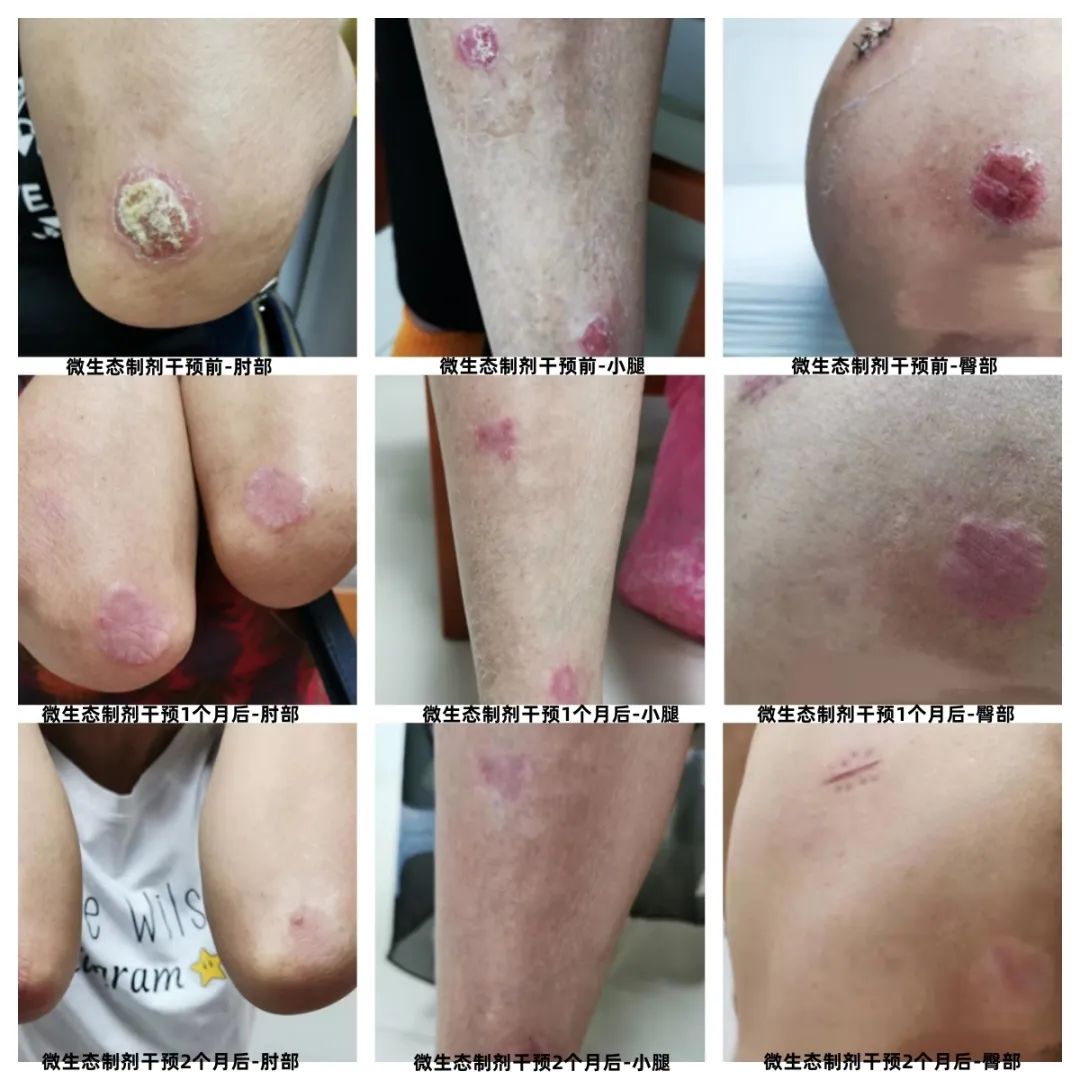
随着时间的推移,陈阿姨的情况越来越好。又一个月后,她回到就诊时,总算是面带笑容了!她告诉我,不痛了,瘙痒大大地减轻,也不腹泻了。我替陈阿姨松了一口气,我观察到她的皮疹状况有了明显改善:大部分的皮疹已经痊愈,皮肤颜色也转为褐色,没有了厚重的皮屑。尽管偶尔还有轻微的瘙痒,但她不再因此而坐立不安,也基本不用再涂药膏。这次的评估显示,她的PAIS评分降至1分,改善了80%,瘙痒VAS评分降至1分,改善了75%。
陈阿姨的治疗取得显著成果,这可能与她的病程较短也有关。银屑病是一种自身免疫性疾病,它需要持续的关注和维护。只有保持健康的生活方式,免疫系统才能保持稳定。所以,她仍然需要保持规律的饮食、健康的生活作息,继续服用肠道微生态制剂,以巩固治疗效果。
患者的笑容,是我们每天工作中最为珍贵的成就之一。陈阿姨的改善也让我更加坚定,肠道微生态制剂能够帮助银屑病患者看到希望、重塑健康。
专业分析
银屑病是一种自身免疫性疾病,“肠屏障功能受损(肠漏)”是诱发慢性炎症(免疫紊乱)的重要原因,食品添加剂、不健康饮食和肥胖、病原菌和毒物、药物和抗生素、器官功能障碍等因素均可能导致肠屏障功能受损,导致有毒物质、细菌、病毒等入血,激活免疫反应(食物不耐受、自身免疫性疾病、炎症等)[1]。银屑病患者存在肠道菌群失调[2],其肠道菌群特征与炎症性肠病患者肠道菌群特征相似[3]。
脆弱拟杆菌BF839可有效治疗肠道炎症、修复肠粘膜屏障。脆弱拟杆菌衍生的3-苯基丙酸通过激活芳烃受体(AhR)信号传导促进肠上皮屏障,保护肠道免受病原体入侵、食物抗原和毒素的侵害[4]。陈阿姨的病程中伴有经常性腹泻的情况,经治疗干预后可能改善了肠道黏膜屏障的完整性,从而减少了腹泻等不适症状,平衡机体免疫。
此外,有学者认为 CD4+ T 淋巴细胞的免疫功能异常对银屑病的病变起关键作用[5],因此 CD4+ T 淋巴细胞的免疫调节被认为可以作为潜在的银屑病治疗靶标。人类共生菌脆弱拟杆菌 (Bacteroides fragilis, BF) 被报道可诱导 CD4+ T 细胞向调节性 T 细胞 (Treg) 分化,从而分泌白细胞介素 10 (IL-10) 等细胞因子抑制炎症性自身免疫反应[6]。经临床试验证明,脆弱拟杆菌 BF839 对银屑病治疗有一定疗效,可降低 PASI 评分及药物使用率,不良反应低,是一种短期有效、安全的治疗方法。[7]
案例中陈阿姨经脆弱拟杆菌BF839制剂干预和规律饮食后,明显改善皮肤症状和腹泻的情况,说明可能她的免疫情况得到稳定,肠道菌群恢复平衡。这一病例为我们提供了在自身免疫性疾病治疗中,肠道微生态调理的重要示范。
参考文献
[1]张嘉楠.了解肠漏综合症[J].人人健康,2022,No.570(13):32-33.
[2] 王丼玮, 罗玱玱, 崔盘根, 等. 肠道菌群与银屑病关系的研究进展. 中华皮肤科杂志, 2019, 52(5): 357-360. Wang LW, Luo LL, Cui PG, et al. Relationship between intestinal flora and psoriasis. Chin J Dermatol, 2019, 52(5): 357-360 (in Chinese).
[3] Scher JU, Ubeda C, Artacho A, et al. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol, 2015, 67(1): 128-139.
[4]Hu J, et al.Gut microbiota-derived 3-phenylpropionic acid promotes intestinal epithelial barrier function via AhR signaling. Microbiome. 2023 May 8;11(1):102.
[5] 程龙龙, 姜述堃, 杜阳, 等. 银屑病的収病机制及其研究进展. 医学综述, 2019, 25(2): 227-232.
[6]Round JL, Mazmanian SK. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota. Proc Natl Acad Sci USA, 2010, 107(27): 12204-12209.
[7]林楚慧,曾婷,邓宇虹等.脆弱拟杆菌BF839治疗寻常型银屑病:一项单臂、开放初步临床试验[J].生物工程学报,2021,37(11):3828-3835.