在基因的困局中寻找曙光:一例GRIN2A突变相关ESES癫痫的免疫治疗经验
作者:余宾
GRIN2A基因突变相关癫痫
GRIN2A 基因突变与癫痫性失语谱系综合征等密切相关。在癫痫病症的谱系中,伴中央颞区棘波的儿童癫痫相对较轻,而睡眠中持续性棘慢波的癫痫性脑病则较为严重,GRIN2A 基因突变在其中扮演重要角色。GRIN2A 基因负责编码 GluN2A 蛋白,它是 NMDA 受体的一个亚基。一旦 GRIN2A 基因发生致病性变异,会致使 NMDA 受体功能出现异常,进而引发癫痫及相关症状。语言功能障碍是这类癫痫常见且严重的合并症。传统抗癫痫药物对严重患者效果不佳。[1]
案例分享
当我们焦虑孩子认了多少字、会说多少英文、乐器考了几级,当我们骄傲孩子考了满分、夺得比赛好成绩、学会了新特长,却有一群父母,他们最大的心愿仅仅是孩子能安稳睡个好觉,能清晰地喊一声"爸爸妈妈",能自己稳稳地走几步路。
7岁的男孩小L,在3岁那年第一次在睡梦中出现抽搐,表现为突发的牙关紧闭、左侧肢体僵硬及抖动,伴有口唇发绀和意识丧失,无发热、口吐白沫或大小便失禁,持续约2分钟后自行缓解。间隔6个月后再次出现类似发作,于门诊完成相关生化及头颅磁共振检查,结果均未见明显异常,临床诊断为癫痫。自此,患儿开始接受口服左乙拉西坦抗发作治疗,初期发作控制良好。
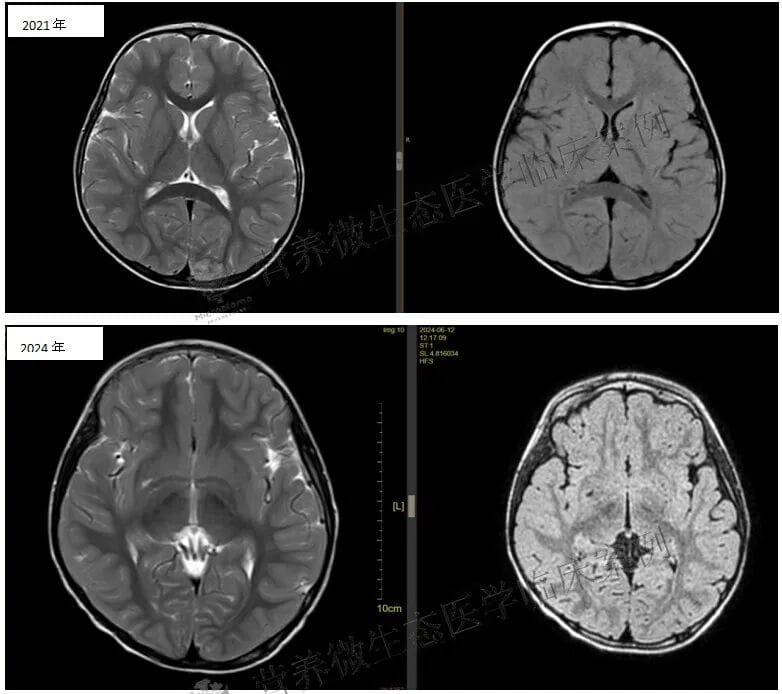
然而,病情在2023年(患儿5岁时)出现转折,睡眠中再次出现两次发作,形式大致同前,但发绀不明显。为此,医疗团队调整了治疗方案,在左乙拉西坦的基础上加用了拉考沙胺进行联合治疗,并逐步将左乙拉西坦剂量上调至0.375g、每日两次(约48mg/kg/日),拉考沙胺调整为50mg、每日两次(约6.6mg/kg/日),期间曾间断使用氯硝西泮以强化控制。更为棘手的是,复查脑电图提示放电指数(SWI)显著增高,同时患儿出现了明显的语言及运动能力倒退,表现为说话停顿、语音含混、行动缓慢伴颤抖,这强烈提示可能存在睡眠中癫痫性电持续状态(ESES)或睡眠期连续棘慢波(CSWS)现象。鉴于这一复杂情况,于2023年11月开始加用第三代抗癫痫药物吡仑帕奈,每晚2mg,形成三联方案。此后,因感觉左乙拉西坦效果不佳,家长在随访中逐渐将其减量至停用,并逐步上调吡仑帕奈剂量。
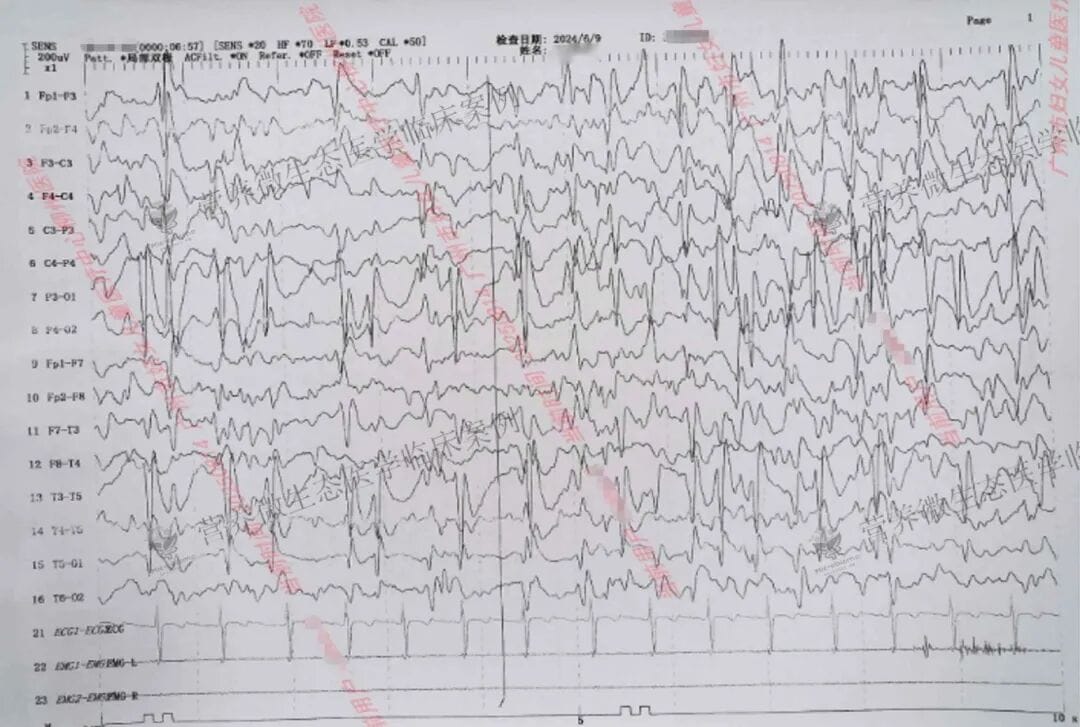
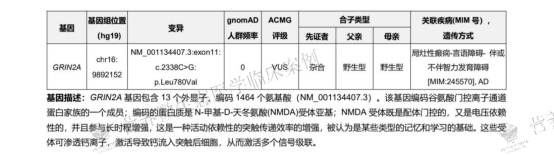
尽管多药联合下发作得到控制,但多次复查脑电图均显示SWI持续在高位,超过85%,意味着大脑持续的异常放电仍在严重损害患儿的认知功能。此时,基因检测结果提供了关键信息:患儿存在GRIN2A基因杂合突变。该突变关联的疾病谱与患儿临床表现高度吻合,包括癫痫、发育迟缓以及特征性的ESES/CSWS脑电图模式。这一发现促使治疗团队必须超越常规抗癫痫药物,寻求更根本的干预策略。
患儿初始临床症状符合睡眠中癫痫伴慢波睡眠期持续棘慢波(Selects)的特点,初期对左乙拉西坦反应良好,也符合该药物的作用机理。但2年后病情进展,出现ESES/CSWS现象及认知倒退,有学者认为:免疫发育障碍在遗传基因突变的发病机制中可能占据重要的位置[2],比如MECP2基因突变导致的Rett综合征可能是一种自身免疫病,MECP2基因的功能丧失可以导致氧化损伤、细胞因子失调、急性期蛋白反应,以及抗神经抗体和N-糖基化肽抗原的特定IgM的发生,这开拓了我们对这些难治性疾病发展新疗法的思路[3]。该患者在添加拉考沙胺和吡仑帕奈后,虽然临床发作控制,但异常放电依旧,说明常规药物难以起效。因此,团队建议进行免疫调节治疗。在家长未同意首选激素冲击方案的情况下,于2024年6月为患儿进行了首次免疫球蛋白静脉输注(剂量为1g/kg)。输注后一周内,患儿情况未见明显变化。在此背景下,为寻求一种能够兼顾控制发作、改善认知,且家长接受度高的长期辅助治疗方案,结合对患儿存在免疫炎症因素的判断以及家长的强烈意愿,遂在首次输注丙种球蛋白约一周后,开始加用口服脆弱拟杆菌BF839制剂进行辅助调理。
在启动BF839治疗(每日两次,每次一包)后,患儿于首次丙球输注后3个月再次接受了第二次丙种球蛋白治疗,至此共完成两次免疫调节。目前的联合治疗方案(吡仑帕奈、BF839及阶段性丙球)取得了阶段性成效:患儿至今已无临床发作,认知、语言和运动功能较前改善,脑电图放电指数也有所下降。
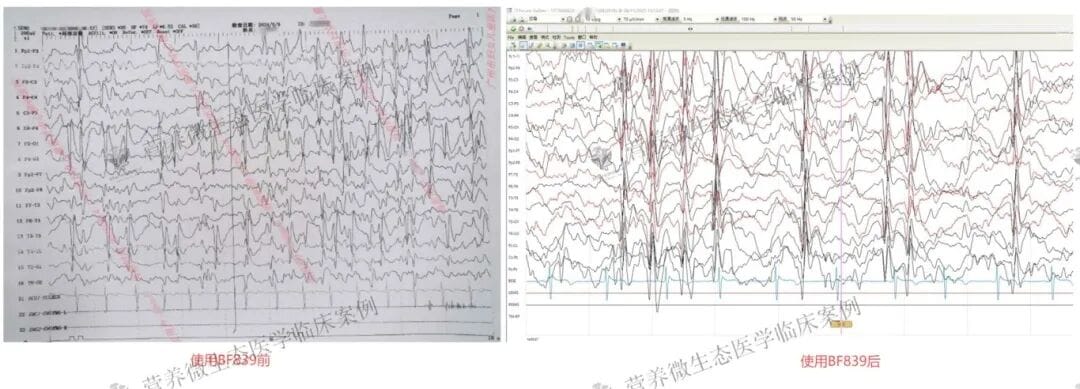
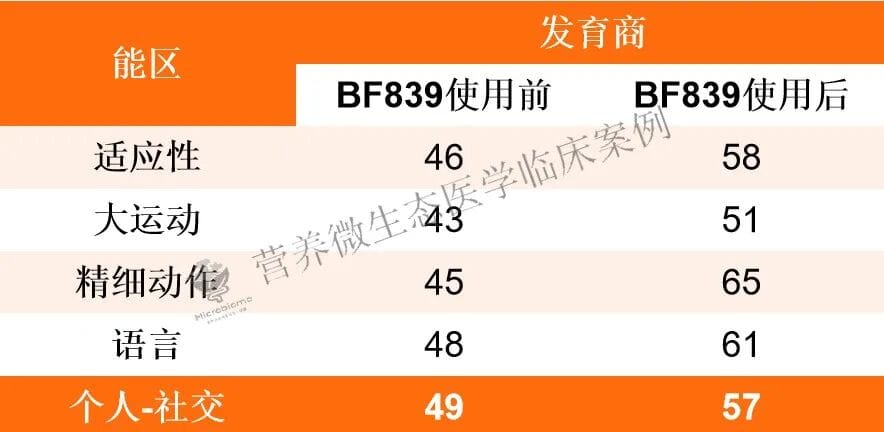
然而,本案例的诊治难点依然存在:异常脑电放电仍未完全消除,且GRIN2A突变所致的发育落后已是既定事实。下一步的治疗考虑包括调整抗癫痫发作药物,例如尝试换用布立西坦,或探讨每月进行一次免疫抑制剂治疗的可能性,以期进一步控制电生理异常,促进神经功能的最大限度恢复。
专业分析
本案例患儿是由GRIN2A基因杂合突变导致的癫痫性脑病,其核心特征是从局灶性发作演变为睡眠中癫痫性电持续状态(ESES)并伴随认知倒退。GRIN2A突变所致NMDA受体功能缺陷在特定发育阶段与睡眠相互作用,为ESES的广泛性痫样放电创造了条件[4]。持续的癫痫活动激活了小胶质细胞等介导的神经炎症,释放IL-1β、IL-6、TNF-α等促炎因子[5],从而形成“异常放电-神经炎症-脑功能损害”的恶性循环。这可能解释了为何常规抗癫痫药物虽能控制临床发作,却难以逆转认知倒退与脑电图异常。
近期广州团队在Theranostics发表的研究为微生态干预提供了重要证据,该研究首次完整揭示了产丁酸益生菌通过“肠道屏障—免疫炎症—血脑屏障—小胶质细胞”多环路协同作用,显著下调重度癫痫发作并延缓首次发作时间的机制[6]。而案例中患儿服用的脆弱拟杆菌BF839在癫痫临床研究中已显示出独特价值。国内多项临床观察表明,BF839作为辅助治疗能显著降低自身免疫性癫痫、难治性癫痫患者的发作频率,改善脑电图异常,并在部分患者中观察到认知功能的提升[7-10]。其作用机制可能通过多途径实现:一方面通过调节肠道菌群平衡,增加短链脂肪酸的产生,抑制促炎因子释放[11];另一方面通过调节Th17/Treg细胞平衡,减轻神经炎症反应[12]。这些作用与近期广州团队关于产丁酸益生菌通过"肠道屏障-免疫炎症-血脑屏障"多环路协同调控癫痫的研究结果相互印证。
特别值得关注的是,BF839在肿瘤领域与PD-1抑制剂联用显示出协同增效作用[13],这一特性提示其在免疫调节方面的潜力。在本案例中,BF839可能通过类似的免疫调节机制,增强了丙种球蛋白的治疗效果,共同作用于神经炎症环路。
“肠–脑轴”干预的候选菌株通过调节肠-脑轴,不仅能够直接抑制癫痫发作,还能为免疫治疗创造更有利的中枢环境,这种多靶点协同作用为难治性癫痫的治疗提供了新的方向。而微生态干预也有望成为癫痫综合治疗的重要组成部分,推动癫痫从“控制症状”走向“修改病程”。
参考文献
[1]Samanta D. GRIN2A-related epilepsy and speech disorders: A comprehensive overview with a focus on the role of precision therapeutics. Epilepsy Res. 2023 Jan;189:107065.
[2] 发作停止,放电消失,营养微生态医学拯救STXBP1基因突变的婴儿痉挛症孩子! 邓宇虹 营养微生态医学临床案例 2025年06月23日 17:13广东
[3]De Felice C, Leoncini S, Signorini C, Cortelazzo A, Rovero P, Durand T, Ciccoli L, Papini AM, Hayek J. Rett syndrome: An autoimmune disease? Autoimmun Rev. 2016 Apr;15(4):411-6. doi: 10.1016/j.autrev.2016.01.011
[4]Salmi M, Bolbos R, Bauer S, et al. Transient microstructural brain anomalies and epileptiform discharges in mice defective for epilepsy and language‐related NMDA receptor subunit gene Grin2a[J]. Epilepsia, 2018, 59(10): 1919-1930.
[5]Kamali A N, Zian Z, Bautista J M, et al. The potential role of pro-inflammatory and anti-inflammatory cytokines in epilepsy pathogenesis[J]. Endocrine, Metabolic & Immune Disorders-Drug Targets (Formerly Current Drug Targets-Immune, Endocrine & Metabolic Disorders), 2021, 21(10): 1760-1774.
[6]Li HF, Niu RL, et al. Lachnospira eligens attenuates epileptogenesis via gut-brain axis regulation of blood-brain barrier integrity and neuroinflammation[J]. Theranostics, 2026, 16(2): 1045-1062.
[7]林楚慧,等.脆弱拟杆菌839治疗新诊断“可能的自身免疫相关癫痫”的疗效[J].癫痫杂志,2022,8(04):298-304.
[8]邓宇虹,等.脆弱拟杆菌(BF839)辅助治疗难治性癫痫有效性的初步临床研究[J].癫痫杂志,2021,7(04):288-295
[9]陈鸿 等.脆弱拟杆菌BF839辅助治疗儿童药物难治性癫痫的随机双盲对照临床研究[D].汕头大学,2022
[10]洪桢.脆弱拟杆菌BF839和鼠李糖乳杆菌复合制剂添加治疗癫痫的疗效和安全性评估:一项多中心、随机、双盲临床试验研究初步成果汇报 [R]. 神经免疫与感染专业委员会2025学术年会暨诊疗热点培训会 [C]. 四川成都,2025.
[11]D'Argenio G, Mazzacca G. Short-chain fatty acid in the human colon. Relation to inflammatory bowel diseases and colon cancer. Adv Exp Med Biol. 1999;472:149-58.
[12]Wang Y, Telesford KM, Ochoa-Repáraz J, Haque-Begum S, Christy M, Kasper EJ, Wang L, Wu Y, Robson SC, Kasper DL, Kasper LH. An intestinal commensal symbiosis factor controls neuroinflammation via TLR2-mediated CD39 signalling. Nat Commun. 2014 Jul 21;5:4432.
[13]Peng K, Li Y, Yang Q, et al. The therapeutic promise of probiotic Bacteroides fragilis (BF839) in cancer immunotherapy. Front Microbiol. 2025;16:1523754. Published 2025 Mar 31.