分享一个不吃药的抽动症治疗方案——营养微生态医学治疗案例
作者:曾婷
抽动症
抽动障碍(tic disorders,TD)是起病于儿童期,以抽动为主要临床表现的神经精神疾病。抽动表现为一种不自主、无目的、快速、刻板的肌肉收缩。病初抽动症状通常从面部开始,逐渐发展到头、颈、肩部肌肉,而后波及躯干及上、下肢。抽动形式也可以从一种形式转变为另一种形式,不断有新的抽动形式出现。
我国儿童TD的总患病率为2.68%,男童总患病率为1.67%,女童总患病率为1.21%,与全球数据接近,男童较女童患病率高。发病与围生期不利因素、慢性呼吸系统疾病、家庭环境等密切相关。
案例展示
2023年7月底,因为肥胖问题,14岁的小毅和妈妈一起来到营养科门诊就诊,目的是寻求减重方案。然而,在检查过程中,我意外地发现了他的抽动症状,经了解,这个症状已经持续了2至3年,主要表现在眼睛和面部的轻微抽动,所以并未引起重视。
除了抽动和肥胖问题,小毅的胃肠道问题也是自小就有的,既往有过过敏性鼻炎和过敏性紫癜。目前就读初中,看着是一个大小伙子了,但他平常容易疲倦,免疫力差,经常感冒,病程还长。
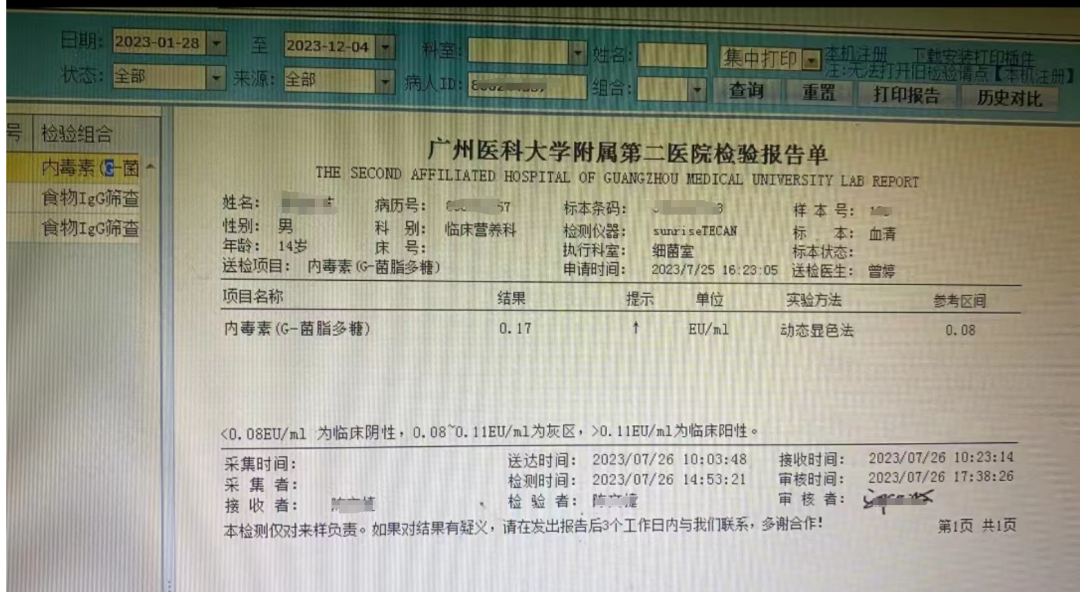
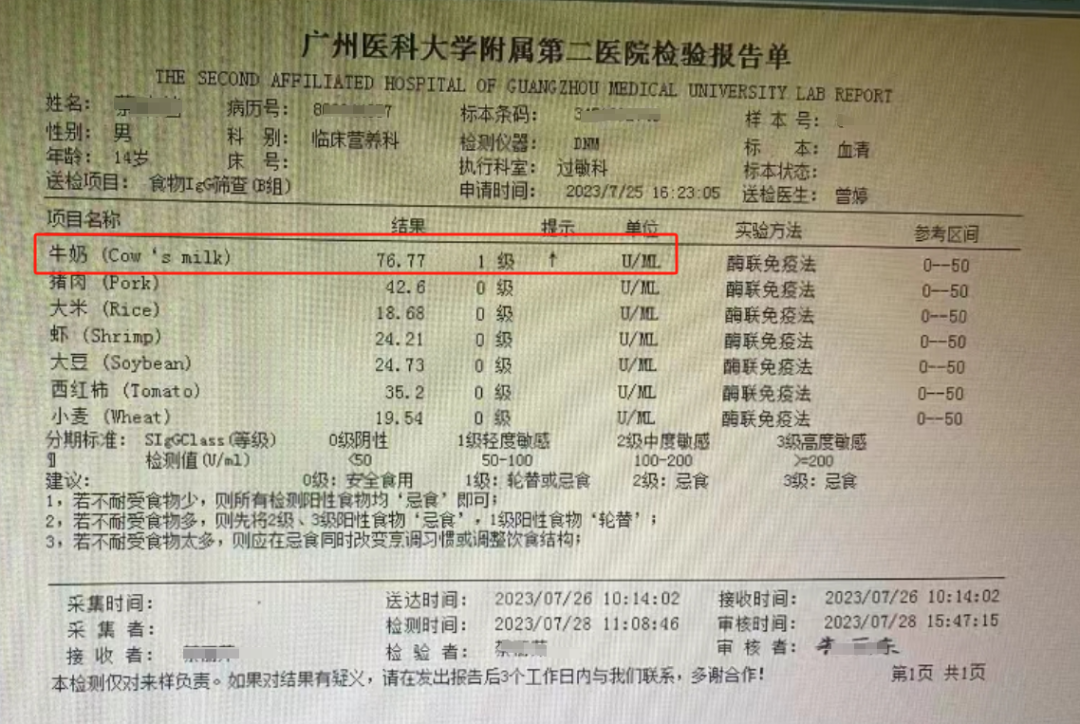
2023年7月26日,小毅进行血液检查,发现内毒素(G-菌脂多糖)高达0.17,意味着内毒素水平异常升高;同时,食物IGg筛查显示对牛奶存在1级阳性反应,提示他不耐受牛奶,这些指标反应了他的胃肠屏障功能比较差。为此,我制定了营养微生态干预方案,饮食戒断+微生态制剂干预(每天10g)。

经过三个多月的干预,这名男孩的家长反馈孩子的抽动症状减轻了,且精神状态和体力都有明显改善。他的食欲良好,排便基本每天有,时而间隔一天,比过去好了许多。在整个暑假中,他积极参与游泳、跑步和跳绳等运动项目。他表示现在虽然耐力较之前提升了,但速度还需要提高。在此过程中,虽然偶尔还会生病感冒,但是病程已经明显变短了,即使生病也能得到较快的恢复。
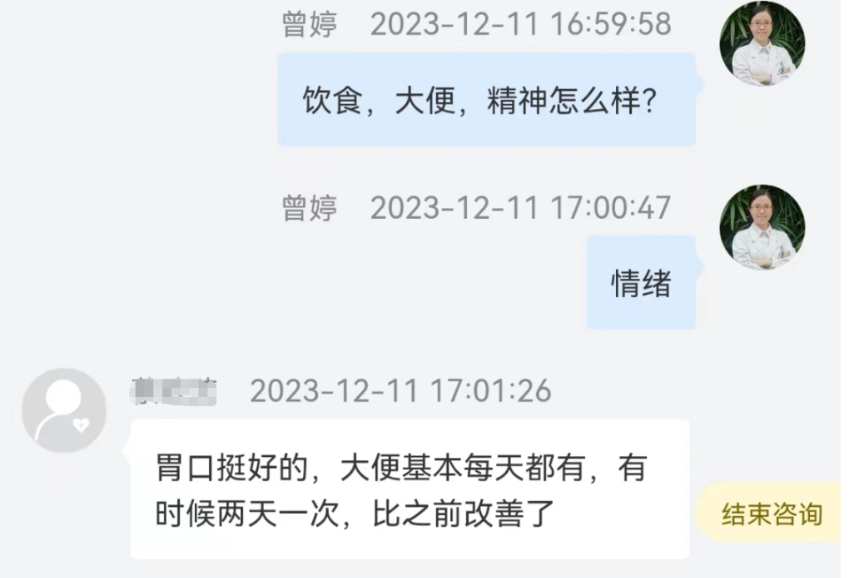
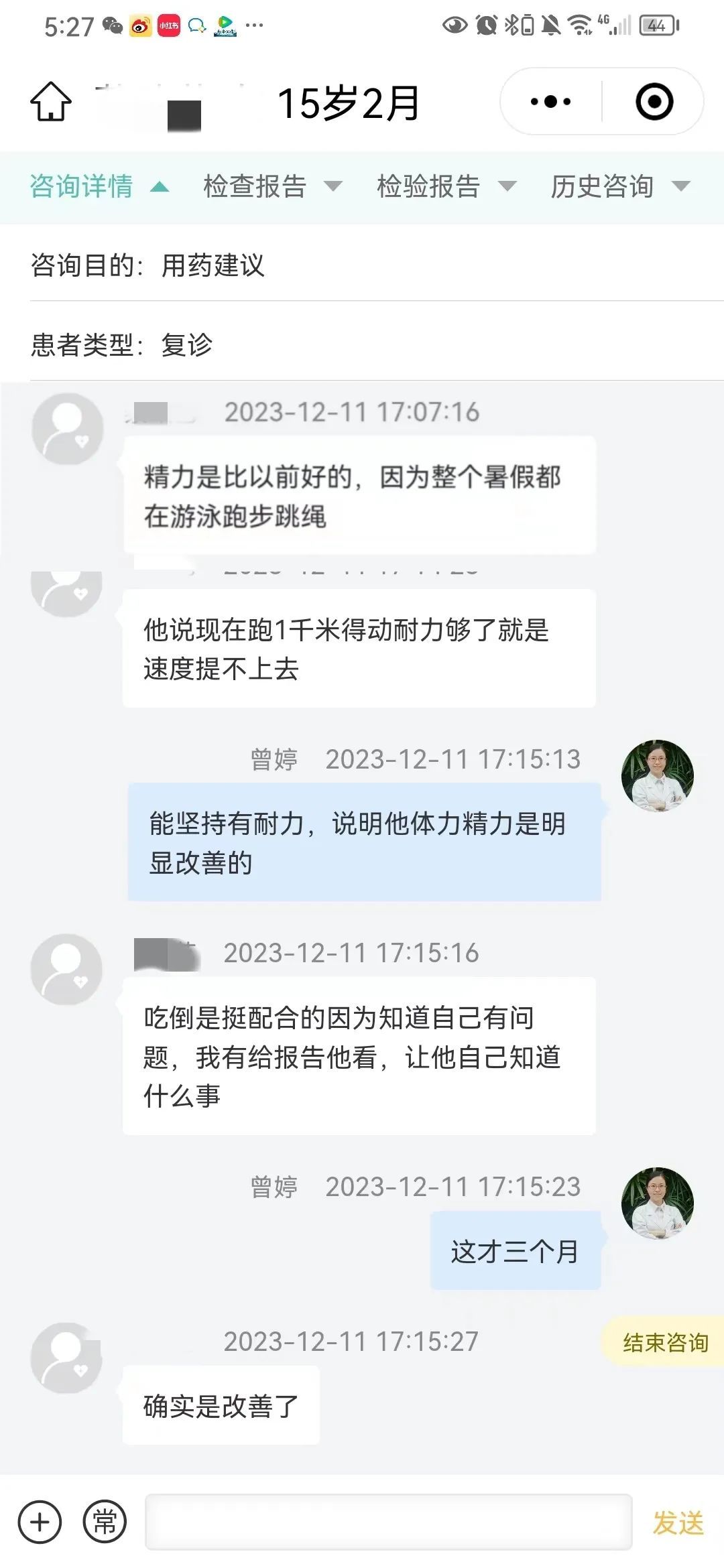
营养肠道微生态干预方案的治疗效果得到了患者和家长的认可,他的家人对治疗方案充满信心。这是我们众多成功案例中的其中一个,每多一位受益的患者、多一位认可肠道微生态技术的病人,都能为我们继续推动这项技术增添一分支持和动力,以让更多的患者收益。
专业分析
抽动症是常见的儿童神经系统疾病,虽然其病理生理机制尚不清楚,大多数研究都集中在皮质纹状体-丘脑皮质回路失控方面。免疫功能紊乱被提出作为抽动症及其相关神经精神障碍(如强迫症、自闭症和注意缺陷/多动障碍)发病机制的一种可能性。包括多巴胺代谢异常、遗传易感性和外部触发因素,可能引发免疫系统失调,影响免疫耐受性和脑内炎症。[1]案例中小毅既往有过过敏性鼻炎和过敏性紫癜,牛奶不耐受、内毒素水平异常升高等都提示其免疫功能存在异常,抽动症可能与其免疫异常有关。
肠道与免疫、神经之间息息相关。[2]研究显示,正常实验模型与抽动症实验模型间的肠道微生物组存在差异;通过FMT(粪菌移植)可以改变抽动症实验模型的肠道微生物组,结果提示了肠脑轴可能参与了抽动症的发展。多巴胺能和5-羟色胺能传递异常可能与抽动症的发病机制有关;肠道菌群能促进色氨酸代谢成5-HT的前体,从而通过血脑屏障,FMT可以通过调节肠道菌群和上调血清5-HT水平来缓解TS小鼠模型的抽搐严重程度。[3]
因此使用肠道微生态制剂有利于重建抽动障碍儿童的肠道新稳态,改善其症状。小毅的免疫异常很有可能是导致其神经发育障碍的主要原因,使用微生态制剂脆弱拟杆菌,通过独特两性离子多糖PSA通过浆泡样树突细胞MHCII通路实现免疫调节是实现改善其神经发育障碍的主要作用机制。[4]鼠李糖乳杆菌可以激活上皮生长因子受体(EGFR),增强5-羟色胺转运体(SERT)的表达,调节肠道中的5-羟色胺能系统,并增加海马和杏仁核中的脑源性神经营养因子和γ-氨基丁酸受体水平,通过脑肠轴干预神经系统疾病。[5]
参考文献
[1]Hsu CJ, Wong LC, Lee WT. Immunological Dysfunction in Tourette Syndrome and Related Disorders. Int J Mol Sci. 2021 Jan 16;22(2):853.
[2]Jacobson A, Yang D, Vella M, Chiu IM. The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes. Mucosal Immunol. 2021 May;14(3):555-565.
[3]Li H, Wang Y, Zhao C, Liu J, Zhang L, Li A. Fecal transplantation can alleviate tic severity in a Tourette syndrome mouse model by modulating intestinal flora and promoting serotonin secretion. Chin Med J (Engl). 2022 Mar 20;135(6):707-713.
[4]Erturk-Hasdemir & Kasper, PSA as the archetypical microbial symbiosis factor, Ann. N.Y. Acad. Sci. (2018) 1-14
[5]Zhou B, etl. Lactobacillus rhamnosus GG colonization in early life regulates gut-brain axis and relieves anxiety-like behavior in adulthood. Pharmacol Res. 2022 Mar;177:106090.

